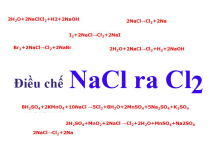SO2 là lưu huỳnh dioxit hay còn được gọi là sulfur dioxit, lưu huỳnh oxit, khí SO2 là chất nặng hơn không khí. SO2 thường được tạo ra từ quá trình sản xuất công nghiệp, quá trình đốt cháy các loại nhiên liệu hóa thạch như dầu, than hoặc quá trình nấu chảy các loại quặng nhôm, kẽm, chì, sắt.
Khí SO2 không có lợi cho sức khỏe của con người cũng như đối với hệ sinh thái. Việc sản sinh quá nhiều khí SO2 cũng là một trong những nguyên nhân làm cho bầu khí quyển ngày càng bị ô nhiễm nhanh chóng.
Một số cách điều chế FeS2 ra SO2 hiện nay
- 4FeS2+11O2→2Fe2O3+8SO2 (trong đó: 4FeS2 {vàng đồng nhạt}; 11O2 {khí không màu}; 2Fe2O3 {nâu đỏ}; 8SO2 {khí, không màu}. Điều kiện: Có nhiệt độ. Dấu hiệu nhận biết: Fe2O3 màu nâu đỏ)
- 2FeS2+14H2SO4→Fe2(SO4)3+14H2O+15SO2 (trong đó: 2FeS2 {rắn, vàng đồng nhạt}; 14H2SO4 {dung dịch, không màu}; Fe2(SO4)3 {dung dịch, nâu nhạt}; 14H2O {lỏng, không màu}; 15SO2 {khí, không màu, mùi hắc}. Cách thực hiện: cho FeS2 tác dụng với dung dịch axit sunfuric. Dấu hiệu nhận biết: Có khí thoát ra).
- 4FeS2+22KMnO4→2Fe2O3+11MnO2+8SO2+11K2MnO4 (trong đó: 4FeS2 {rắn}; 22KMnO4 {rắn, màu tím}; 2Fe2O3 {rắn}; 11MnO2 {rắn}; 8SO2 {khí}; 11K2MnO4 {rắn}. Cách thực hiện: FeS2 tác dụng với KMnO4. Dấu hiệu: Có khí thoát ra
- 3FeS2+20HNO3→12H2O+11NO+6SO2+3Fe(NO3)3 (trong đó: 3FeS2 {rắn}; 20HNO3 {dd loãng, không màu}; 12H2O {lỏng, không màu}; 11NO {khí, không màu}; 6SO2 {khí, không màu, mùi hắc}; 3Fe(NO3)3 {dd}; Dấu hiệu nhận biết: Rắn màu vàng tan dần, dung dịch chuyển màu vàng nâu, khí không màu bay lên hóa nâu trong không khí)
- FeS2+14HNO3→7H2O+11NO2+2SO2+Fe(NO3)3 (trong đó: 14HNO3 {dd đặc}; 11NO2 {khí, nâu đỏ}; 2SO2 {khí, không màu}. Dấu hiệu nhận biết: Có khí màu nâu đỏ và khí có mùi sốc thoát ra là NO2 và SO2)
- FeS2+3O2→SO2+FeSO4