Axit sunfuric H2SO4 là gì?. Axit sunfuric (H2SO4) là một axit vô cơ gồm các nguyên tố lưu huỳnh, oxy và hydro. Công thức hóa học của Axit sunfuric là H2SO4. Axit sunfuric là hóa chất ở dạng lỏng không màu, không mùi, sánh, hòa tan trong nước và phản ứng tỏa nhiệt cao
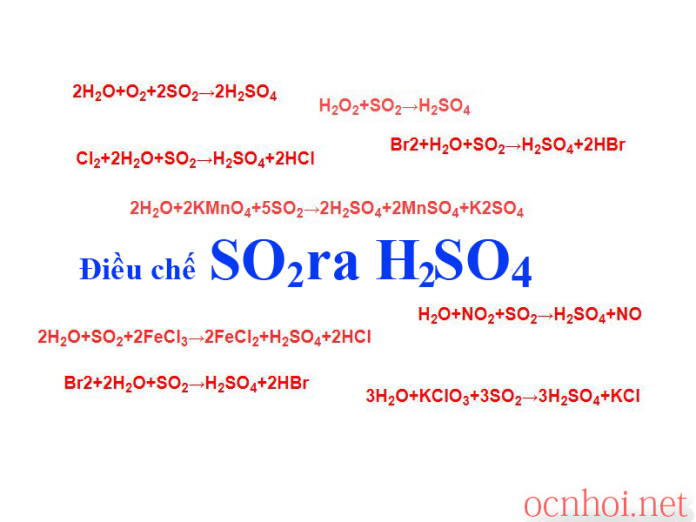
Điều chế SO2 ra H2SO4 bằng cách nào
Để điều chế được H2SO4 từ SO2 chúng ta có các phương trình hóa học như sau:
- 2H2O+O2+2SO2→2H2SO4 (trong đó: 2H2O {lỏng, không màu} + O2 {khí, không màu}; 2SO2 {khí, không màu}; 2H2SO4 {dd,, không màu})
- 2H2O+2KMnO4+5SO2→2H2SO4+2MnSO4+K2SO4 (trong đó: 2H2O {lỏng, không màu};2KMnO4 {dung dịch, màu tím}; 5SO2 {khí, không màu, mùi sốc}; 2H2SO4 {dd, không màu}; 2MnSO4 {dd}; K2SO4 {rắn, trắng}. Điều kiện phản ứng: dung môi: H2SO4 loãng, Cách thực hiện phản ứng: cho dd SO2 qua thuốc tím; Hiện tượng nhận biết: dung dịch thuốc tím Kalipenmaganat (KMnO4) nhạt màu dần trong quá trình phản ứng hóa học.
- 2H2O+SO2+2FeCl3→2FeCl2+H2SO4+2HCl (trong đó: 2H2O {dd, không màu}; SO2 {khí, không màu}; 2FeCl3 {dd, vàng nâu}; H2SO4 {dd, không màu}; 2HCl {dung dịch, không màu}. Cách thực hiện: cho khí SO2 tác dụng với FeCl3. Dấu hiệu: Màu vàng nâu dung dịch sắt III FeCl3 (clorua) đổi sang màu xanh nhạt từ dung dịch sắt II clorua (FeCl2)
- 3H2O+KClO3+3SO2→3H2SO4+KCl (trong đó: 3H2O {lỏng, không màu}; KClO3 {rắn, trắng}; 3SO2 {khí, không màu}; 3H2SO4 {dd, không màu}; KCl {rắn, trắng}. Điều kiện: nhiệt độ. Cách thực hiện: cho KClO tác dụng với SO2 trong điều kiện ẩm
-
H2O+NO2+SO2→H2SO4+NO (trong đó: H2O {lỏng, không màu}; NO2 {khí, nâu đỏ}; SO2 {khí, không màu, mùi khai}; H2SO4 {dd, không màu}; NO {khí, không màu}. Điều kiện: Nhiệt độ. Dấu hiệu: Khí không màu hoá nâu trong không khí
-
Br2+H2O+SO2→H2SO4+2HBr (trong đó: Br2 {lỏng, nâu đỏ}; H2O {lỏng, không màu}; SO2 {khí, không màu}; H2SO4 {lỏng, không màu}; 2HBr {lỏng, không màu}. Cách thực hiện: Sục khí SO2 vào dung dịch Brom. Dấu hiệu nhận biết: Màu nâu đỏ của dung dịch Brom mất màu)
-
Br2+2H2O+SO2→H2SO4+2HBr (trong đó: Br2 {lỏng, nâu đỏ}; 2H2O {lỏng, không màu}; SO2 {khí, không màu}; H2SO4 {dd, không màu}; 2HBr {dd, không màu}. Cách thực hiện: sục khí SO2 qua dung dịch nước brom. Dấu hiệu: SO2 làm nhạt màu dung dịch nước brom
-
Cl2+2H2O+SO2→H2SO4+2HCl (trong đó: Cl2 {khí, không màu, mùi sốc}; 2H2O {lỏng, không màu}; SO2 {khí, không màu, mùi hắc}; H2SO4 {dung dịch, không màu}; 2HCl {dd, không màu}. Cách thực hiện: cho clo tác dụng với dung dịch SO2).
-
2SO2+(NH3OH)2SO4→H2SO4+2HSO3NH2 (trong đó: 2HSO3NH2 {kt}. Điều kiện: oleum)
-
H2O2+SO2→H2SO4
-
2H2O+2HNO3+3SO2→3H2SO4+2NO
- Fe2(SO4)3+2H2O+SO2→2H2SO4+2FeSO4
- 2H2O+SO2+2At→H2SO4+2HAtf
- H2O+SO2+(NH3OH)Cl→H2SO4+NH4Cl
- H2O+2SO2+H2TeO3→2H2SO4+Te
- 2H2O+I2+SO2→H2SO4+2HI
- 2H2O+SO2+2HgCl2→H2SO4+2HCl+Hg2Cl2
-
2H2O+SO2+2CuCl2→H2SO4+2HCl+2CuCl
-
4H2O+5SO2+2NaIO3→4H2SO4+I2+Na2SO4
Một số cách điều chế H2SO4 khác
- 2H2O {lỏng, không màu} +2KMnO4 {dung dịch, màu tím} + 5SO2 {khí, không màu, mùi sốc} → 2H2SO4 {dd, không màu} + 2MnSO4 {dd} + K2SO4 {rắn, trắng} Lưu ý: Điều kiện phản ứng: dung môi: H2SO4 loãng, Cách thực hiện phản ứng: cho dd SO2 qua thuốc tím; Hiện tượng nhận biết: dung dịch thuốc tím Kalipenmaganat (KMnO4) nhạt màu dần trong quá trình phản ứng hóa học.
- 2H2O + 2ZnSO4 {dd}→2H2SO4 {dd}+O2 {khí}+2Zn {rắn} (điều kiện phản ứng: điện phân)
-
(NH4)2SO4 → H2SO4 + 2NH3 (Trong đó: (NH4)2SO4 {rắn}, H2SO4 {dd, không màu}, 2NH3 {khí, không màu})
-
O2 + 2H2SO3 → 2H2SO4 (trong đó: O2 {khí, không màu}; 2H2SO3 {dd}; 2H2SO4 {dd, không màu})
-
2HNO3 + S → H2SO4 +2NO (trong đó: 2HNO3 {dd, không màu}; S {rắn, vàng chanh}; H2SO4 {dd, không màu}; 2NO {khí, không màu})
-
4Cl2 + 4H2O + H2S → H2SO4 + 8HCl (trong đó:4Cl2 {khí, vàng lục}; 4H2O {lỏng, không màu}; H2S {khí không màu}; H2SO4 {dd, không màu}; 8HCl {dd, không màu})
-
6HNO3 + S → 2H2O + H2SO4 + 6NO2 (trong đó: 6HNO3 {dd đậm đặc, không màu}; S {rắn, vàng}; 2H2O {lỏng, không màu}; H2SO4 {dd, không màu}; 6NO2 {khí, nâu đỏ})